Quy tắc hình bình hành là gì? Ứng dụng và các dạng bài tập?
Khám phá quy tắc hình bình hành trong toán học và vật lý, cách áp dụng và bài tập minh họa giúp bạn hiểu rõ hơn.
Quy tắc hình bình hành là một công cụ quan trọng trong toán học và vật lý, giúp tính tổng và hiệu của hai vectơ. Bài viết này sẽ giúp bạn hiểu rõ hơn về quy tắc này và cách ứng dụng nó trong các bài tập thực tế.
Quy tắc hình bình hành là gì?
Quy tắc hình bình hành, thường được sử dụng trong lĩnh vực hóa học, đặc biệt là trong phân tích cấu trúc phân tử, đề cập đến một phương pháp xác định cấu hình 3D của các phân tử dựa trên các cặp electron và các liên kết hóa học. Dưới đây là một cái nhìn chi tiết về quy tắc này.

Khái niệm cơ bản
Quy tắc hình bình hành là một phương pháp mô tả cách các nguyên tử và các cặp electron ở lớp vỏ ngoài cùng (cặp liên kết và cặp đơn) sắp xếp trong không gian để tối thiểu hóa lực đẩy giữa chúng. Quy tắc này thường được áp dụng trong việc xác định hình dạng của các phân tử có liên quan đến lý thuyết về các cặp electron ở lớp vỏ ngoài cùng (VSEPR theory).
Nguyên tắc hoạt động
Cặp electron: Các electron ở lớp vỏ ngoài cùng tồn tại dưới dạng cặp, có thể là cặp liên kết (electron chia sẻ giữa hai nguyên tử) hoặc cặp đơn (electron không tham gia vào liên kết). Các cặp electron này tạo ra lực đẩy lẫn nhau, và việc sắp xếp chúng trong không gian nhằm giảm thiểu lực đẩy sẽ dẫn đến hình dạng của phân tử.
Sắp xếp tối ưu: Quy tắc hình bình hành nhấn mạnh rằng các cặp electron sẽ sắp xếp theo cách tối ưu để đạt được cấu trúc có năng lượng thấp nhất, đồng thời duy trì khoảng cách tối ưu giữa các nguyên tử để giảm lực đẩy.
Cấu trúc phân tử và hình dạng
Phân tử tuyến tính: Khi một phân tử có 2 cặp electron (không phân biệt liên kết hoặc cặp đơn), chúng sẽ sắp xếp theo hình dạng tuyến tính (180 độ). Ví dụ, phân tử carbon dioxide (CO₂) có hình dạng tuyến tính.
Phân tử hình chữ V: Khi có 3 cặp electron (và 1 cặp đơn), như trong phân tử amoniac (NH₃), hình dạng sẽ là hình chữ V. Hình dạng này được hình thành do sự đẩy của cặp electron đơn đối với các cặp liên kết.
Phân tử hình tam giác phẳng: Với 3 cặp electron (tất cả đều là liên kết), như trong phân tử boron trifluoride (BF₃), hình dạng sẽ là tam giác phẳng (120 độ).
Phân tử tứ diện: Khi có 4 cặp electron (tất cả đều là liên kết), như trong phân tử metan (CH₄), hình dạng sẽ là tứ diện (109.5 độ).
Ứng dụng trong hóa học
Phân tích cấu trúc phân tử: Quy tắc hình bình hành được sử dụng để xác định hình dạng 3D của các phân tử và từ đó suy luận về tính chất hóa học và vật lý của chúng.
Dự đoán tính chất phản ứng: Hình dạng phân tử ảnh hưởng đến cách thức mà các phản ứng hóa học xảy ra, bao gồm cả tốc độ phản ứng và sản phẩm tạo thành.
Cách vận dụng quy tắc hình bình hành
Quy tắc hình bình hành, thường được sử dụng trong hóa học để mô tả cấu trúc không gian của các phân tử, giúp xác định cách các nguyên tử và cặp electron sắp xếp xung quanh nguyên tử trung tâm. Dưới đây là cách vận dụng quy tắc này một cách chi tiết.

Hiểu rõ về cấu trúc phân tử
Trước khi vận dụng quy tắc hình bình hành, cần hiểu rõ các khái niệm cơ bản:
- Cặp electron: Các electron trong lớp vỏ ngoài cùng của nguyên tử có thể tồn tại dưới dạng cặp liên kết (electron chia sẻ giữa hai nguyên tử) hoặc cặp đơn (electron không tham gia vào liên kết).
- Nguyên tử trung tâm: Trong một phân tử, nguyên tử trung tâm là nguyên tử có nhiều cặp electron nhất, và nó thường quyết định hình dạng tổng thể của phân tử.
Xác định số lượng cặp electron
Bước 1: Xác định số electron ở lớp vỏ ngoài cùng của nguyên tử trung tâm. Sử dụng cấu hình điện tử hoặc bảng tuần hoàn để xác định số electron.
Bước 2: Tính tổng số cặp electron bằng cách chia số electron ở lớp vỏ ngoài cùng cho 2. Nếu có các liên kết với nguyên tử khác, hãy tính thêm số electron từ các liên kết đó.
Ví dụ: Trong phân tử nước (H₂O):
- Oxy (O) có 6 electron ở lớp vỏ ngoài cùng.
- Oxy tham gia vào 2 liên kết với 2 nguyên tử hydro, nghĩa là nó có 4 electron (2 cặp electron liên kết) và 2 electron còn lại (1 cặp electron đơn).
- Tổng cộng có 3 cặp electron (2 cặp liên kết + 1 cặp đơn).
Áp dụng quy tắc hình bình hành để xác định hình dạng
Bước 3: Sử dụng số cặp electron để xác định hình dạng của phân tử. Theo quy tắc hình bình hành, các cặp electron sẽ sắp xếp để giảm thiểu lực đẩy giữa chúng. Một số hình dạng cơ bản là:
- Tuyến tính: 2 cặp electron (180 độ) - ví dụ: CO₂.
- Tam giác phẳng: 3 cặp electron (120 độ) - ví dụ: BF₃.
- Tứ diện: 4 cặp electron (109.5 độ) - ví dụ: CH₄.
- Hình chữ V: 3 cặp electron (2 cặp liên kết, 1 cặp đơn) - ví dụ: NH₃ hoặc H₂O.
Vẽ cấu trúc Lewis
Bước 4: Vẽ cấu trúc Lewis cho phân tử. Cấu trúc này giúp minh họa cách các electron được phân bố và các liên kết giữa các nguyên tử.
Quy trình vẽ:
Xác định số electron cần thiết để hoàn thành quy tắc octet cho từng nguyên tử.
Kết nối các nguyên tử bằng liên kết đơn, sau đó thêm electron cho đến khi tất cả các nguyên tử đạt được cấu hình ổn định.
Đánh dấu các cặp electron đơn và các liên kết bằng các ký hiệu thích hợp.
Ví dụ minh họa
Ví dụ 1: Phân tử Amoniac (NH₃)
Xác định cặp electron: Nitrogen (N) có 5 electron, cần 3 electron để tạo liên kết với 3 nguyên tử hydro. Có 1 cặp electron đơn.
Tổng số cặp electron: 4 (3 cặp liên kết + 1 cặp đơn).
Áp dụng quy tắc: 4 cặp electron sẽ tạo hình dạng tứ diện, nhưng với 1 cặp đơn, hình dạng thực tế là hình chữ V.
Vẽ cấu trúc Lewis:
Nitrogen ở giữa với 3 liên kết với hydro và 1 cặp electron đơn. Cấu trúc là H-N-H, với cặp electron đơn ở trên.
Ví dụ 2: Phân tử Nước (H₂O)
Xác định cặp electron: Oxy (O) có 6 electron, liên kết với 2 hydro (2 cặp electron liên kết), còn lại 2 electron (1 cặp đơn).
Tổng số cặp electron: 3 (2 cặp liên kết + 1 cặp đơn).
Áp dụng quy tắc: 3 cặp electron sẽ tạo hình chữ V.
Vẽ cấu trúc Lewis:
Oxy ở giữa với 2 liên kết với hydro và 1 cặp electron đơn. Cấu trúc là H-O-H, với cặp electron đơn ở trên.
Kiểm tra và điều chỉnh
Bước 5: Sau khi xác định hình dạng, hãy kiểm tra xem hình dạng đó có nhất quán với các tính chất hóa học và vật lý của phân tử hay không. Nếu không, có thể cần điều chỉnh số lượng liên kết hoặc cặp electron.
Công thức liên quan đến quy tắc hình bình hành
Quy tắc hình bình hành là một công cụ quan trọng trong hóa học để xác định hình dạng của các phân tử dựa trên sự sắp xếp của các cặp electron. Dưới đây là các công thức và khái niệm liên quan đến quy tắc hình bình hành, cũng như các thông tin chi tiết để giúp bạn hiểu rõ hơn.

Số lượng cặp electron
Để xác định số lượng cặp electron xung quanh nguyên tử trung tâm của một phân tử, bạn có thể sử dụng công thức:

Cách tính:
- Xác định số electron ở lớp vỏ ngoài cùng của nguyên tử trung tâm.
- Cộng thêm số electron mà nguyên tử trung tâm nhận được từ các nguyên tử khác khi hình thành liên kết (mỗi liên kết đơn cho 2 electron).
- Chia tổng số electron cho 2 để xác định số cặp electron.
Ví dụ minh họa:
- Phân tử H₂O (nước):
- Oxy có 6 electron ở lớp vỏ ngoài cùng.
- Oxy liên kết với 2 nguyên tử hydro, cung cấp thêm 2 electron. Tổng cộng có 8 electron.
- Số cặp electron: 8/2 = 4 cặp electron (bao gồm 2 cặp liên kết và 2 cặp đơn).
Hình dạng phân tử
Dựa vào số cặp electron, có thể xác định hình dạng của phân tử. Các hình dạng chính theo quy tắc hình bình hành bao gồm.
| Số cặp electron | Hình dạng | Góc liên kết |
| 2 | Tuyến tính | 180° |
| 3 | Tam giác phẳng | 120° |
| 4 | Tứ diện | 109.5° |
| 5 | Bipyramidal | 120° và 90° |
| 6 | Hình vuông | 90° |
Các công thức tính toán liên quan
Góc liên kết
Góc liên kết trong một phân tử có thể được ước lượng dựa trên số cặp electron và hình dạng phân tử như sau:
- Tuyến tính: 180°
- Tam giác phẳng: 120°
- Tứ diện: 109.5°
- Bipyramidal: 120° (trong mặt phẳng) và 90° (trục đứng)
- Bát diện (hình vuông): 90°
Tính điện tích của nguyên tử
Để tính điện tích của các nguyên tử trong phân tử, có thể sử dụng công thức sau:
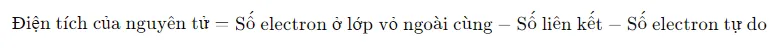
Điều này giúp hiểu rõ hơn về tính chất hóa học của phân tử, bao gồm tính phân cực và khả năng phản ứng.
Ứng dụng của quy tắc hình bình hành
- Phân tích cấu trúc phân tử: Quy tắc này giúp xác định hình dạng của phân tử và từ đó suy luận về tính chất hóa học và vật lý của nó, như độ bền, khả năng hòa tan, và phản ứng.
- Dự đoán phản ứng hóa học: Hình dạng của phân tử ảnh hưởng đến cách nó tương tác với các phân tử khác. Điều này rất quan trọng trong việc dự đoán sản phẩm của các phản ứng hóa học.
Ví dụ minh họa
Ví dụ 1: Phân tử Methan (CH₄)
- Tính số cặp electron:
- Carbon có 4 electron ở lớp vỏ ngoài cùng.
- Carbon hình thành 4 liên kết đơn với hydro (mỗi liên kết cung cấp 2 electron).
- Tổng số electron: 4+4=84 + 4 = 8.
- Số cặp electron: 8/2 = 4 ( tất cả là cặp liên kết )
- Hình dạng và góc liên kết:
- Hình dạng: Tứ diện.
- Góc liên kết: 109.5°.
Ví dụ 2: Phân tử Amoniac (NH₃)
- Tính số cặp electron:
- Nitrogen có 5 electron ở lớp vỏ ngoài cùng.
- Nitrogen liên kết với 3 hydro, cung cấp thêm 3 electron. Tổng cộng có 8 electron.
- Số cặp electron: 8/2 = 4 ( 3 cặp liên kết, 1 cặp đơn )
- Hình dạng và góc liên kết:
- Hình dạng: Hình chóp tam giác (do cặp electron đơn đẩy các cặp liên kết, gây ra biến dạng từ hình tứ diện).
- Góc liên kết: khoảng 107°.
Quy tắc hình bình hành không chỉ giúp bạn giải quyết các bài toán liên quan đến vectơ mà còn có ứng dụng rộng rãi trong vật lý và kỹ thuật. Nắm vững quy tắc này sẽ giúp bạn cải thiện khả năng phân tích và giải quyết vấn đề trong học tập và công việc. Hãy áp dụng ngay hôm nay!
Bài Viết Liên Quan
Với kinh nghiệm lâu năm trong lĩnh vực viết lách, Tôi là chuyên gia trong việc cung cấp các bài viết chi tiết về các quy tắc và hướng dẫn trên website.







